Aceclofenaco
Monografía
Acción terapéutica
El aceclofenaco es un antiinflamatorio no esteroideo indicado en procesos inflamatorios y dolorosos como:
- Lumbalgia.
- Periartritis escápulohumeral.
- Reumatismo extraarticular.
- Osteartritis crónica.
- Artritis reumatoide.
- Espondilitis anquilosante.
Más información
Se estima que la enzima CYP2C9 metaboliza el 50% del aceclofenaco. El 50% restante, lo metabolizan un grupo diverso de enzimas del citocromo P450. Además, aunque hasta la fecha se han descrito más de 30 variantes en la región codificante del gen CYP2C9, solamente las variantes CYP2C9*2 y CYP2C9*3 son frecuentes en población europea y tienen consecuencias funcionales sobre la enzima CYP2C9, por lo que en la práctica clínica la determinación de estas dos variantes podría considerarse suficiente.
Metabolismo
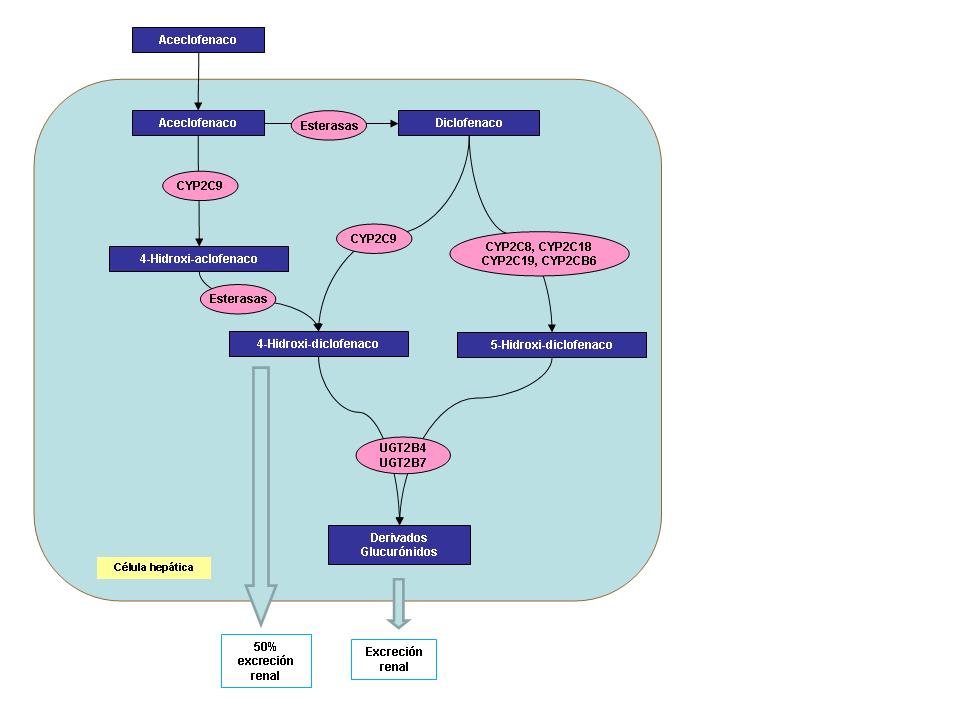
Tras su administración oral, el aceclofenaco se absorbe rápida y completamente en forma de fármaco inalterado. Se une en un 99% a proteínas plasmáticas.
Se metaboliza a 4’-hidroxi-aceclofenaco por la enzima CYP2C9, y a diclofenaco a través de esterasas plasmáticas. El 4’-hidroxi-aceclofenaco se tranforma en 4’-hidroxi-diclofenaco por también por acción de esterasas plasmáticas. El metabolismo del diclofenaco se lleva a cabo por diversos mecanismos de hidroxilación y acetil-glucuronación. Alrededor del 50% del diclofenaco se elimina como 4’-hidroxi-diclofenaco, un producto del CYP2C9. El otro metabolito en humanos, el 5-hidroxi-diclofenaco parece ser el producto de varias enzimas entre las que se incluyen CYP2C8, CYP2C18, CYP2C19 y CYP2B6. Se cree que también interviene la enzima CYP3A4, aunque su papel no está lo suficientemente estudiado.
El resto del fármaco es metabolizado las enzimas UGT2B4 y UGT2B7. El derivado glucurónido del diclofenaco es metabolizado por el CYP2C8.
Aproximadamente las dos terceras partes de la dosis administrada se excretan por la orina, fundamentalmente en forma de hidroximetabolitos.
Otros factores a tener en cuenta
En general, los AINE deben emplearse con precaución cuando se utilizan con otros fármacos que pueden aumentar el riesgo de ulceración, hemorragia gastrointestinal o disfunción renal. Además, en la ficha técnica del aceclofenaco se recomienda que, para minimizar las reacciones adversas, se deben utilizan menores dosis eficaces durante el menor tiempo posible para controlar los síntomas.
Es importante considerar la dosis de aceclofenaco administrada, principalmente por dos motivos: (1) porque las reacciones adversas gastrointestinales del aceclofenaco son dosis-dependientes y (2) porque la presencia de la variantes CYP2C9*2 y sobre todo la de la variante CYP2C9*3, podría dar lugar a la síntesis de una enzima con una velocidad de metabolización inferior a la de la enzima salvaje. Como consecuencia, se produciría una sobredosis relativa del fármaco en sangre que incrementaría el riesgo de sufrir hemorragias gastrointestinales. El efecto terapéutico, sin embargo, tiene dosis techo.
Existen otras reacciones adversas descritas, menos frecuentes y no dosis-dependientes, entre las que destacan el daño cardiovascular y las reacciones de hipersensibilidad. El daño cardiovascular se ha descrito sobretodo en pacientes con hipertensión o trastornos renales que les predispongan a sufrir retención hídrica.
Los medicamentos sustratos del CYP2C9, como la warfarina, la fenitoína u otros AINEs, deben utilizarse con precaución en pacientes que toman celecoxib, debido al hecho de que el CYP2C9 es su principal vía de metabolismo y podrían producirse mecanismos de inhibición competitiva.
A pesar de que existen estudios que proponen considerar otros genes que codifican otras enzimas implicadas en la biodisponibiliadad de los AINEs (como son enzimas transportadoras o las propias ciclooxigenasas), hasta la fecha no existen estudios de asociación que relacionen la presencia de alguna variante en dichos genes con un incremento en el riesgo de sufrir reacciones adversas en pacientes pertenecientes a población europea expuestos a aceclofenaco.
A efectos prácticos en clínica, diferentes estudios in vitro han demostrado que la presencia de la variante CYP2C9*2 y sobretodo de la variante CYP2C9*3, da lugar a la síntesis de una enzima con la velocidad de metabolización mucho menor que la de la salvaje, de forma que los pacientes portadores de estas variantes y consumidores de aceclofenaco, sufrirán una sobredosificación, que podría incrementar el riego de aparición de las reacciones adversas dosis-dependiente del aceclofenaco, por lo que sería recomendable iniciar el tratamiento con dosis aproximadamente del 50% y evaluar la reacción farmacológica y de posibles efectos secundarios.
Conclusiones
Es importante tener en cuenta que más del 50% del aceclofenaco es metabolizado por la enzima CYP2C9. El consumo de dosis habituales de aceclofenaco por sujetos portadores de las variantesCYP2C9*2 y sobretodo de laCYP2C9*3, podría dar lugar a una sobredosis relativa que incrementaría el riesgo de sufrir hemorragias gastrointestinales, debido a la naturaleza dosis-dependiente de estas RAM.
Sin embargo, todavía es necesario realizar estudios que (1) cuantifiquen el incremento del riesgo de sufrir HGI en pacientes portadores de dichas variantes y expuestos a aceclofenaco, y (2), que determinen cuál es la dosis correcta para los pacientes con este perfil, para poder utilizarlo a posteriori en la práctica clínica diaria.
La determinación genética de las variantes codificantes del CYP2C9, podría disminuir la morbilidad gastrointestinal derivada del consumo de aceclofenaco, ya que podría evitarse la sobredosificación y, de esta forma, se minimizaría la aparición de las reacciones adversas dosis-dependientes.
Bibliografia
- Agúndez J et al (2009). Genetically based impairment in CYP2C8 and CYP2C9 dependent metabolism as a risk factor for gastrointestinal bleeding: Is a combination of pharmacogenomics and metabolomics required to improve personalized medicine? Expert Opin. Drug Metab. Toxicol; 5: 1-14.
- Blanco G et al (2008). Interaction of CYP2C8 and CYP2C9 genotypes modifies the risk for nonsteroidal anti-inflammatory drugs-related acute gastrointestinal bleeding. Pharmacogenet Genomics; 18: 37-43.
- Bort R et al (1996). Metabolism of aceclofenac in humans. Drug Metab Dispos; 24: 834-841.
- Carbonell N et al (2010). CYP2C9*3 loss-of-function allele is associated with acute upper gastrointestinal bleeding related to the use of NSAIDs other than aspirin. Clinical Pharmacology and Therapeutics; 87: 693-698.
- Crespi CL et al (1997). The R144C change in the CYP2C9*2 allele alters interaction of the cytochrome P450 with NADPH:cytochrome P450 oxidoreductase. Pharmacogenetics; 7: 203–1
- Daily EB et al (2009). Cytochrome P450 2C8 pharmacogenetics. A review of clinical studies. Pharmacogenomics; 10: 1489-1510.
- Haining RL et al (1996). Allelic variants of human cytochrome P450 2C9: baculovirus-mediated expression purification, structural characterization, substrate stereoselectivity and prochiral selectivity of the wild-type and I359L mutant forms. Arch Biochem Biophys; 333: 447–58.
- Higashi MK et al (2002). Association between CYP2C9 genetic variants and coagulation-related outcomes during warfarin therapy. JAMA; 287: 1690-1698.
- Laporte JR (2004). Upper gastrointestinal bleeding associated with the use of NSAIDs. Newer versus older agents. Drug Safety; 27: 411-420.
- Martin JH et al (2001). Is cytochrome P450 2C9 genotype associated with NSAID ulceration? Br J Clin Pharmacol; 51: 627-630.
- Musumba C et al (2009). Review article: cellular and molecular mechanisms of NSAID-induced peptic ulcers. Aliment Pharmacol Ther; 30: 517–531.
- Pilotto A et al (2007). Genetic susceptibility to nonsteroidal anti-inflammatory drug-related gastroduodenal bleeding: role of cytochrome P450 2C9 polymorphisms. Gastroenterology; 133: 465-471.
- Rettie AE et al (1994). Impaired S-warfarin metabolism catalyzed by R144C allelic variant of CYP2C9. Pharmacogenetics; 4: 39–42.
- Sánchez-Diz P et al (2009). Prevalence of CYP2C9 polymorphisms in the south of Europe. Pharmacogenomics J; 9: 306-10.
- Van Oijen et al (2006). Effect of a Specific Cyclooxygenase-Gene Polymorphism (A-842G/C50T) on the Occurrence of Peptic Ulcer Hemorrhage. Dig Dis Sci; DOI 10.1007/s10620-006-9475-8.
- Vonkeman HE et al (2006). Allele variants of the cytochrome P450 2C9 genotype in white subjects from the Netherlands with serious gastroduodenal ulcers attributable to the use of NSAIDs. Clin Ther; 28: 1670-1676.
Información adicional
Ana Estany GestalLicenciada en Farmacia (USC)
Last modified: Sep 6, 2017 @ 09:59 am